Ustekinumabihoidon kliininen hyöty suomalaisilla Crohnin tauti -potilailla
Ustekinumabia on käytetty psoriasiksen hoidossa jo yli 10 vuoden ajan, mutta Crohnin taudin hoidossa se on vielä suhteellisen uusi valmiste.1 Suomalaisessa takautuvassa FINUSTE-monikeskustutkimuksessa selvitettiin tosielämän tietoon pohjautuen ustekinumabihoidon vaikuttavuutta Crohnin tautia sairastavilla potilailla. Tosielämän tieto eli ns. real-world data (RWD) antaa arvokasta lisätietoa valmisteen käytöstä todellisessa, valikoimattomassa potilasaineistossa, kun taas kliiniset tutkimukset toteutetaan kontrolloidussa asetelmassa ja rajatulla potilasryhmällä.2
Ustekinumabi on (humaani) monoklonaalinen IgG1κ-vasta-aine, joka sitoutuu spesifisesti interleukiini-12:n ja interleukiini-23:n yhteiseen p40-proteiinin alayksikköön estäen näiden sytokiinien tulehdusreaktiota aktivoivat vaikutukset. Ustekinumabia käytetään immuunivälitteisten tautien, kuten psoriaasin, nivelpsoriaasin, Crohnin taudin ja haavaisen paksusuolitulehduksen, hoitoon. Vuonna 2016 ustekinumabi sai myyntiluvan keskivaikeaa tai vaikeaa Crohnin tautia sairastavilla potilailla, jotka eivät ole saaneet riittävää vastetta perinteisellä lääkehoidolla tai TNF-alfan estäjähoidolla.3 Ustekinumabin teho ja turvallisuus Crohnin taudin hoidossa osoitettiin kliinisellä tutkimusohjelmalla (UNITI-tutkimukset).4
FINUSTE-tutkimuksen asetelma ja aineisto
FINUSTE-tutkimuksen tavoitteena oli selvittää ustekinumabin kliinistä vastetta, ustekinumabin annostelutiheyttä, hoidon keskeytyksen syitä sekä muiden lääkkeiden samanaikaista käyttöä suomalaisilla Crohnin tautia sairastavilla aikuispotilailla. Ustekinumabihoito oli aloitettu vuoden 2017 aikana valmisteyhteenvedon mukaisesti suonensisäisellä induktioannoksella.
Tutkimus toteutettiin 12 sairaalan monikeskustutkimuksena, jonka aineisto koostui 48 Crohnin tautia sairastavasta potilaasta. Hoitoon liittyvät tiedot kerättiin takautuvasti sairauskertomuksista. Tutkimusaineisto koostui potilaista, joilla oli pitkä Crohnin taudin sairaushistoria ja vaikea, hoitoresistentti taudinkuva (Taulukko 1).5
FINUSTE-tutkimuksen päätulokset
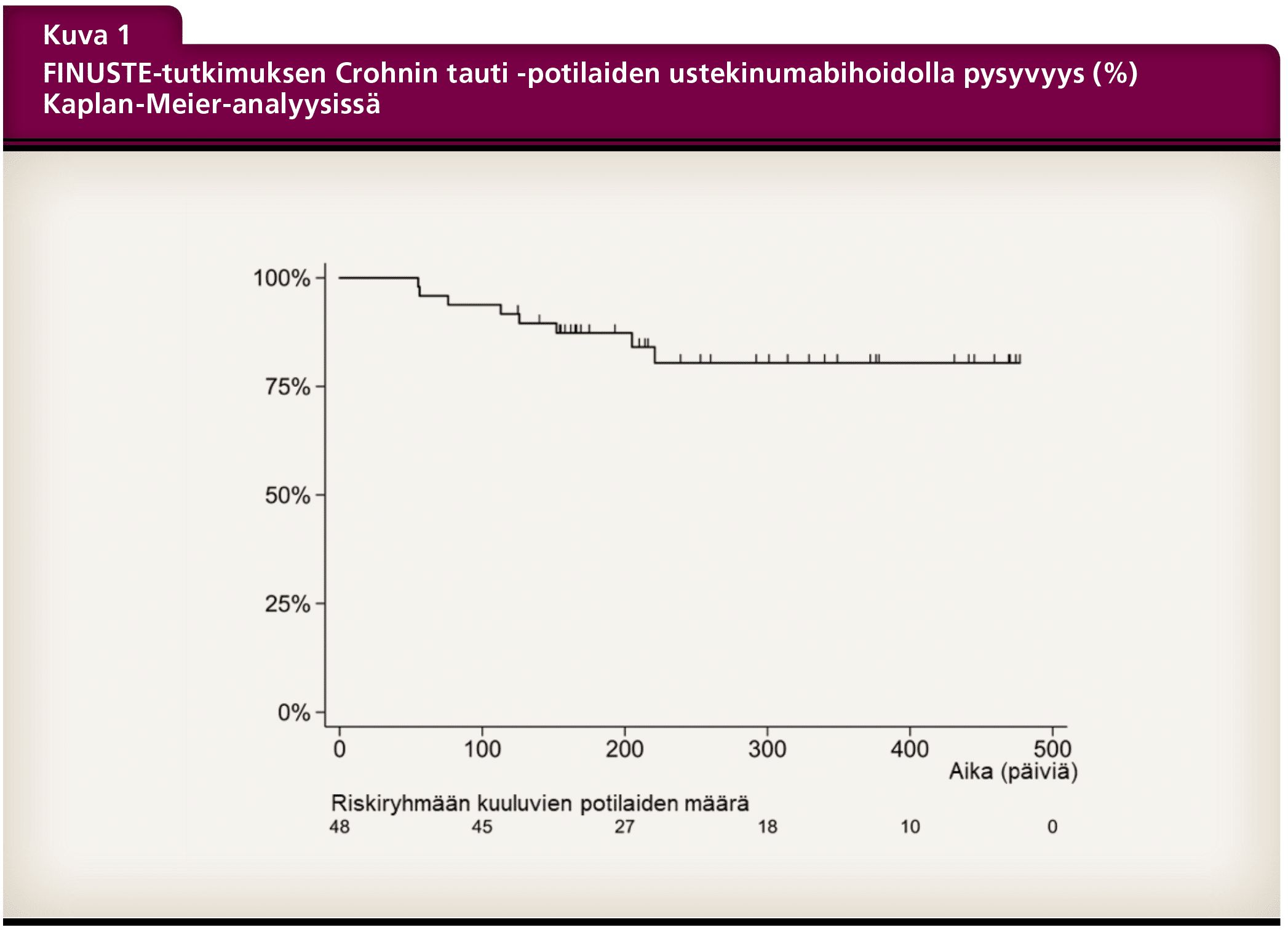
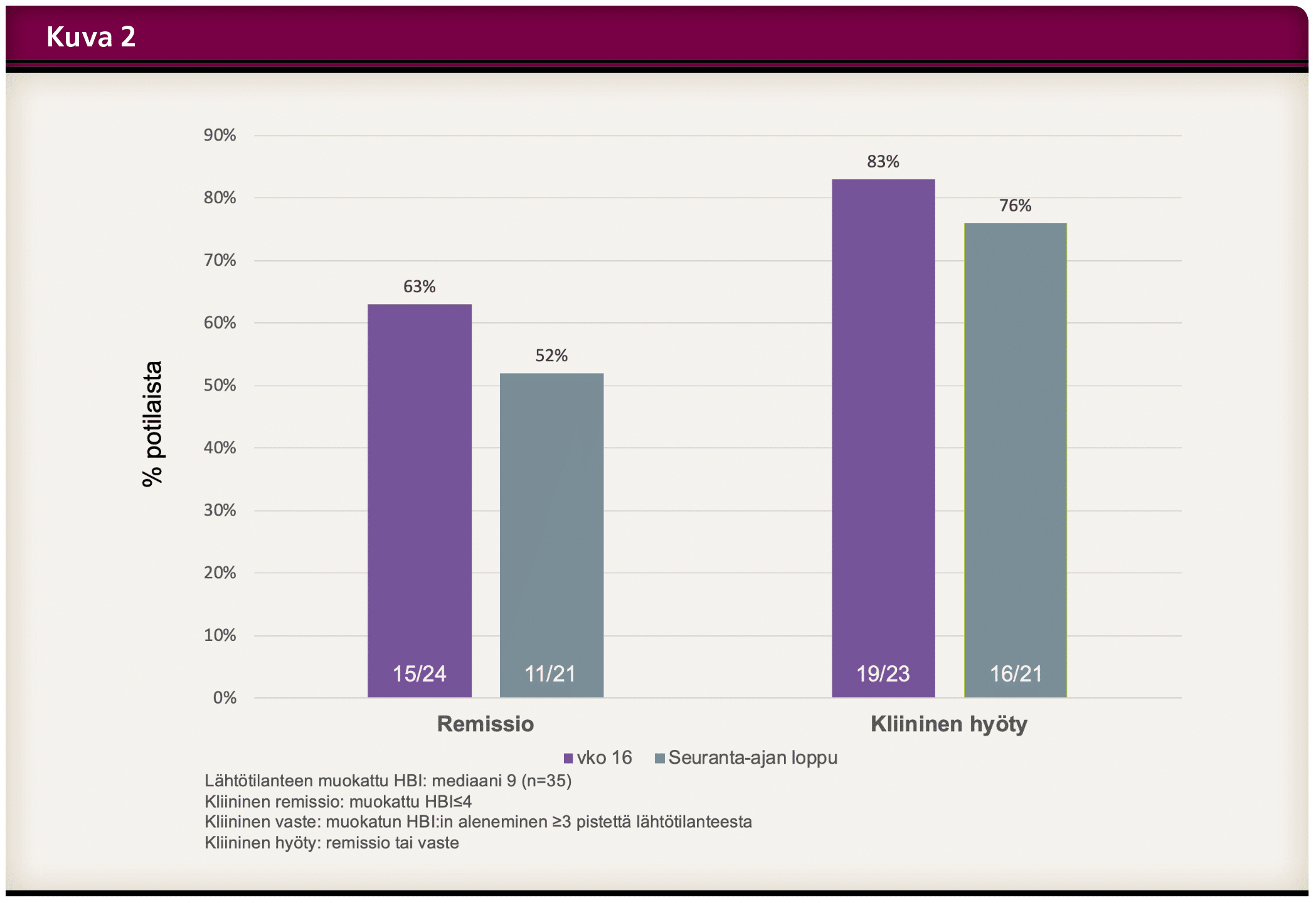
Tutkimuksen seuranta-ajan lopussa 40 (83 %) potilasta jatkoi ylläpitohoitoa ustekinumabipistoksina ihon alle joko 8 viikon tai 12 viikon välein (Kuva 1). Hoidon keskeytti yhteensä 8 potilasta. Keskeytyksen syitä olivat hoitovasteen puute, infektio, raskaus ja mahdollinen allerginen reaktio. Kliinisen tehon määrityksessä käytettiin muokattua Harvey-Bradshaw-indeksiä (mHBI). Kliininen remissio havaittiin 16 viikon kohdalla 63 %:lla ja seuranta-ajan päättyessä 52 %:lla potilaista. Kliinisen hyödyn eli joko vasteen tai remission saavutti seuranta-ajan loppuun mennessä 76 % potilaista (Kuva 2). Tutkimuksen takautuvan luonteen vuoksi aktiviteetti-indeksiä ei ollut saatavilla kaikilta potilailta.
Tutkimuksen aikana kortikosteroidilääkityksen käyttö väheni merkittävästi, lähtötilanteen 48 %:sta 25 %:iin 16 viikon kohdalla ja 13 %:iin seuranta-ajan loppuun mennessä (p=0,001). Seuranta-ajan lopussa 88 % potilaista sai ustekinumabia ilman samanaikaista kortikosteroidihoitoa, ja ustekinumabia monoterapiana saavien potilaiden määrä oli kaksinkertaistunut.
Endoskooppista vastetta hoidolle arvioitiin SES-CD-pisteytyksellä, jonka avulla luokitellaan ohutsuolen loppuosan ja paksusuolen tulehduksen aktiivisuutta.6 FINUSTE-aineistossa tämä endoskooppinen pisteytys oli saatavilla vain osalla potilaista (n=17). Näillä potilailla endoskooppisessa aktiivisuudessa todettiin merkittävä lasku 16 viikon seurannassa, SES-CD-mediaanin laskiessa 12:ta 3:een (p=0,002).5
Johtopäätökset
Takautuvassa FINUSTE-monikeskustutkimuksessa oli mukana 12 suomalaista sairaalaa, joissa käytetään ustekinumabia Crohnin tautia sairastavien potilaiden hoidossa. Tutkimuksen aineisto on valtakunnallisesti hyvin kattava, sisältäen suurimman osan niistä aikuispotilaista, joille hoito aloitettiin ensimmäisenä Suomessa vuonna 2017.
FINUSTE-tutkimuksessa yli 80 % Crohnin tauti -potilaista jatkoi seuranta-ajan päättyessä ustekinumabiylläpitohoidolla, ja kolme neljästä potilaasta saavutti kliinisen hyödyn eli joko vasteen tai remission. Tutkimuksen aikana potilaiden kortikosteroidilääkityksen käyttö väheni alle kolmasosaan alkutilanteesta. Myös endoskooppiset vasteet paranivat merkittävästi potilasryhmässä, jossa SES-CD-pisteytystieto oli saatavilla. Haittavaikutusten seurauksena tapahtuvia hoidon keskeytyksiä esiintyi tutkimuksen aikana kaksi. Tutkimuksen tulokset vahvistavat tietoa ustekinumabin turvallisuudesta ja kliinisestä hyödystä myös valikoimattomassa potilasaineistossa, joka koostui hoidolle resistentin, pitkäkestoisen ja komplisoituneen tautifenotyypin omaavista potilaista.

-
Tutkimuksessa ustekinumabihoidolla saatiin laajalti hyvä hoitovaste Crohnin tautia sairastavilla potilailla, ja hoito jatkui valtaosalla potilaista tutkimuksen tiedonkeruun loppuessa. Tehdyn tutkimuksen perusteella meillä on käytettävissä varteenotettava lääkevaihtoehto kohtalaisesti tai vaikea-asteisesti aktiivisen Crohnin taudin hoitoon. Käynnissä olevan jatkotutkimuksen, FINUSTE 2:n, tavoitteena on saada lisätietoa ustekinumabihoidon hyödystä Crohnin taudin hoidossa suuremmalla potilasjoukolla ja pidemmän seuranta-ajan kuluessa.
-
Sidonnaisuudet:
Nuutinen on saanut puhuja- tai konsulttipalkkioita: Pfizer, Janssen-Cilag, Sanofi, Ferring, MSD, AbbVie ja Takeda. Hemmilä toimii tieteellisenä asiantuntijana Medaffcon Oy:ssä. Eberl on saanut konsultointipalkkioita: MSD, Pfizer, Takeda ja Janssen-Cilag; tutkimusapuraha: Janssen-Cilag. Sipponen on saanut puhujapalkkioita: Abb-Vie, Ferring, Janssen-Cilag, MSD, Pfizer, Takeda ja Tillotts Pharma; konsultointipalkkioita: Hospira, Janssen-Cilag, Pfizer, Takeda ja MSD; tutkimusapuraha: Janssen-Cilag ja Takeda. -
1. Koutruba N, Emer J, Lebwohl M. Review of ustekinumab, an interleukin-12 and interleukin-23 inhibitor used for the treatment of plaque psoriasis. Ther Clin Risk Manag 2010;6:123–141. 2. Kennedy-Martin T, Curtis S, Faries D, Robinson S, Johnston J. A literature review on the representativeness of randomized controlled trial samples and implications for the external validity of trial results. Trials 2015 Nov 3;16:495. 3. Summary of product characteristics, SmPC. Janssen Pharmaceutical Companies 2016. Osoitteessa: http://www.janssenlabels.com/package-insert/product-monograph/prescribinginformation/STELARA-pi.pdf. 4. Faegan BD, Gasink C, Jacobstein D, Lang Y, Friedman JR, Blank MA, Johanns J, Gao LL, Miao Y, Adedokun OJ, Sands BE, Hanauer SB, Vermeire S, Targan S, Ghosh S, de Villiers WJ, Colombel JF, Tulassay Z, Seidler U, Salzberg BA, Desreumaux P, Lee SD, Loftus EV Jr, Dieleman LA, Katz S, Rutgeerts P. Ustekinumab as Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med 2016 Nov 17;375(20):1946–1960. 5. Eberl A, Hallinen T, Af Björkesten CG, Heikkinen M, Hirsi E, Kellokumpu M, Koskinen I, Moilanen V, Nielsen C, Nuutinen H, Suhonen UM, Utriainen K, Vihriälä I, Soini E, Wennerström C, Nissinen R, Borsi A, Koivunen M, Tillonen J, Sipponen T. Ustekinumab for Crohn’s disease: a nationwide real-life cohort study from Finland (FINUSTE). Scand J Gastroenterol 2019 Jun;54(6):718–725. 6. Daperno M, D’Haens G, Van Assche G, Baert F, Bulois P, Maunoury V, Sostegni R, Rocca R, Pera A, Gevers A, Mary JY, Colombel JF, Rutgeerts P. Development and validation of a new, simplified endoscopic activity score for Crohn’s disease: the SES-CD. Gastrointest Endosc 2004;60(4):505–512.

