P-VERIFY: Kattava tosielämän kokonaiselossaolon (OS) vertaileva analyysi CDK4/6-estäjistä yhdessä aromataasi-inhibiittorin kanssa HR+/HER2- metastasoituneessa rintasyövässä
- Tosielämän tutkimuksilla on merkittävä rooli rintasyövän hoitokäytäntöjen selvittämisessä, hoidollesoveltuvien potilasryhmien tunnistamisessa sekä hoidon valintaan ja korvattavuuteen liittyvän päätöksenteon tukemisessa.1
- CDK4/6-estäjän ja hormonaalisen hoidon yhdistelmää suositellaan ensisijaisena vaihtoehtona ensilinjan hoidoksi hormonireseptoripositiivisessa (HR+), HER2-negatiivisessa (HER2–) edenneessä rintasyövässä ellei levinnyt syöpä ole edennyt nopeasti eikä potilaalla ole välittömästi henkeä uhkaavia etäpesäkkeitä.2
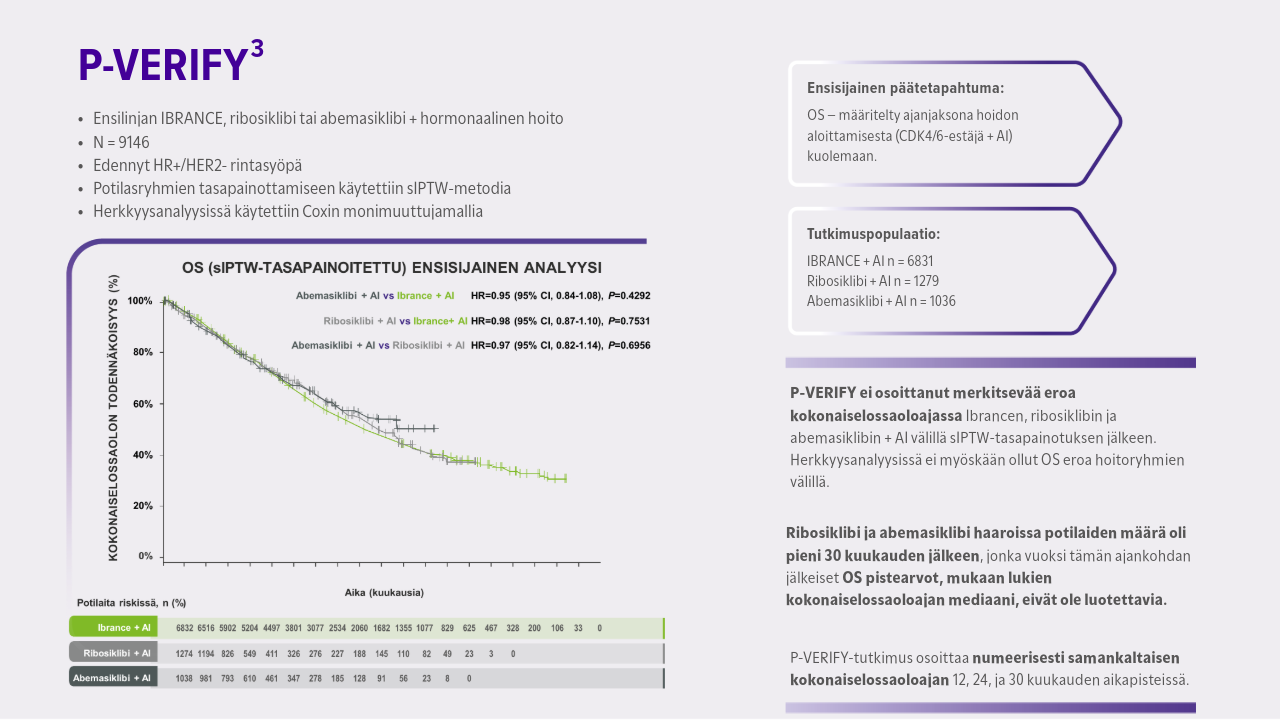
- P-VERIFY on suurin tosielämän vertaileva kokonaisselossaolon analyysi ensimmäisen linjan CDK4/6-estäjistä yhdistettynä hormonaaliseen hoitoon hormonireseptoripositiivisessa (HR+), HER2-negatiivisessa (HER2–) edenneessä rintasyövässä.3
Kliinisessä PALOMA-2-tutkimuksessa palbosiklibin ja letrotsolin yhdistelmän osoitettiin pidentävän merkitsevästi etenemisvapaata elinaikaa postmenopausaalisilla naisilla verrattuna pelkkään hormonaaliseen hoitoon (mediaani PFS 27,6 kk vs. 14,5 kk, p< 0,0001, seuranta-ajan mediaani noin 38 kk).4 Yhdistelmähoitoa saaneilla potilailla oli pelkkää hormonaalista hoitoa saaneisiin verrattuna myös numeerisesti pidempi kokonaiselinaika (mediaani OS 53,9 kk vs. 51,2 kk, seuranta-ajan mediaani 90 kk), mutta ero ei ollut tilastollisesti merkitsevä.5 Ribosiklibillä yhdistettynä hormonaaliseen hoitoon on kliinisissä tutkimuksissa osoitettu tilastollisesti merkitsevä kokonaiselossaoloajan etu (63,9kk).6 Abemasiklibillä yhdistettynä hormonaaliseen hoitoon on kliinisissä tutkimuksissa osoitettu kliinisesti merkitsevä kokonaiselossaoloajan etu (66,8kk). Tulos ei ollut tilastollisesti merkitsevä.7
P-VERIFY-tutkimus
P-VERIFY-tutkimus on suurin tosielämän vertailuanalyysi kokonaiselossaolosta (OS) HR+/HER2- metastasoitunutta rintasyöpää (mBC) sairastavilla potilailla, joita on hoidettu ensilinjassa CDK4/6-estäjillä yhdessä aromataasi-inhibiittorin (AI) kanssa.3
P-VERIFY-tutkimuksen ensisijaisena tavoitteena oli verrata kokonaiselossaoloa HR+/HER2- mBC-potilailla, jotka saivat ensimmäisen linjan hoitoa Ibrancella, ribosiklibillä tai abemasiklibillä yhdessä AI:n kanssa, perustuen reaalimaailman kliinisiin käytäntöihin.3
Tutkimuksessa käytettiin Flatiron Health -tietokantaa, joka sisältää kattavat ja ajantasaiset tiedot yli 700 000 rintasyöpäpotilaasta. Tämä valtakunnallinen tietokanta on koottu käyttämällä luonnollisen kielen käsittelyä ja koneoppimisteknologioita potilastietojen yksityiskohtaiseen abstraktioon.3,8
P-VERIFY-tutkimuksen yhteenveto
Suurimmassa tosielämän vertailevassa kokonaiselossaoloanalyysissä CDK4/6 estäjien välillä ei havaittu merkittävää eroa tuloksissa. P-VERIFY tutkimuksen havainnot viittaavat siihen, että CDK4/6-estäjien+AI välillä ei ole merkittävää eroa kokonaiselossaoloajassa.3 Tämän analyysin tulokset ovat linjassa nykyisten ESMO mBC Living Guidelines -ohjeiden kanssa, joissa todetaan, että vaikka kolmen hyväksytyn CDK4/6-estäjän välillä ei ole tehty suoraa vertailua, näiden kolmen lääkkeen tehokkuus metastaattisen taudin hoidossa näyttää samankaltaiselta. Näiden kolmen lääkkeen siedettävyysprofiilit ovat hieman erilaiset, ja potilaat, joille kehittyy yhdelle CDK4/6-estäjälle tyypillinen vakava toksisuus, voivat vaihtaa toiseen.9,10 P-VERIFY tutkimuksessa ei raportoitu turvallisuusprofiiliin liittyvää dataa.3
Tutkimuksen vahvuuksia ja rajoitteita
P-VERIFY-tutkimuksen vahvuuksiin kuuluu, että se on laajin tosielämän vertaileva kokonaisselossaoloanalyysi CDK4/6-estäjien + AI välillä (n = 9146). Tutkimusaineisto on laajasta ja monimuotoisesta Flatiron-tietokannasta, ja elossaoloajan määrittelyyn on käytetty useita lähteitä ja validoitu National Death Index menetelmällä. P-VERIFY-tutkimuksessa on hyödynnetty sIPTW- tasapainotusmenetelmää kohorttien välisen tasapainon ja vertailukelpoisuuden varmistamiseksi. Tasapainottamattoman ja tasapainotettujen aineistojen tulokset olivat keskenään samankaltaisia. Tutkimuksen löydökset pysyivät samankaltaisina riippumatta siitä oliko hoito aloitettu 2017 tai myöhemmin kaikkien CDK4/6-estäjien ollessa saatavilla.3
P-VERIFY tutkimuksella on lukuisa rajoitteita. Retrospektiivisellä analyysillä ei voida päätellä kausaliteettia eikä tuloksia tule suoraan verrata satunnaistettujen tutkimusten tuloksiin. Kuten yleisesti retrospektiivisissä tutkimuksissa, myös tässä tietolähde (Flatiron-tietokanta) on voinut sisältää osin puutteellisia tai virheellisiä tietoja. Ribosiklibi- ja abemasiklibi-haarojen potilasjoukko ja seuranta-aika oli pienempi verrattuna Ibrance-haaraan, jonka vuoksi OS-pistervot (mm. kokonaiselossaolon mediaani) 30 kuukauden aikapisteen jälkeen eivät ole luotettavia. sIPTW-tasapainotusmenetelmä ei voi huomioida havaitsemattomia muuttujia, joten mahdollisia sekoittavia tekijöitä ei voida täydellisesti poistaa. Tutkimuksessa esitetyt havainnot eivät välttämättä ole yleistettävissä muille kuin Flatiron-tietokannan potilasryhmille.3
PP-IBR-FIN-0455-012025
-
Viitteet
- Cottu P, et al. Breast. 2022 Feb;61:118-122.; 2. Suomen Rintasyöpäryhmä ry.: Rintasyövän valtakunnallinen diagnostiikka- ja hoitosuositus, päivitysversio 1/2025; 3. Rugo HS et al. ESMO Open. 2025 Jan, Vol 10; 1, 104103.; 4. Rugo HS, et al. Breast Cancer Res Treat 2019;174:719-729.; 5. Slamon DJ et al. Overall Survival With Palbociclib Plus Letrozole in Advanced Breast Cancer. J Clin Oncol. 2024 Jan 22:JCO2300137. doi: 10.1200/JCO.23.00137.; 6. Hortobagyi GN, Stemmer SM, Burris HA, et al. Overall survival with ribociclib plus letrozole in advanced breast cancer. N Engl J Med. 2022;386(10):942-950. doi:10.1056/NEJMoa2114663.; 7. Goetz et al. 2024. Ann Oncol.2024 Aug;35(8):718-727. doi: 10.1016/j.annonc.2024.04.013. Epub 2024 May 8.; 8. Flatiron Health. Maximize use cases across your oncology portfolio with a comprehensive, disease-specific solution. Flatiron Health website. Vierailtu joulukuu 2024. Saatavilla: https://page.flatiron.com/panoramic-data-rwe.; 9. Gennari A, et al. Ann Oncol 2021;32(12):1475–1495; 10. ESMO. Metastatic Breast Cancer Living Guidelines, v1.1 May 20 23. vierailtu joulukuu 2024.
-
IBRANCE (palbosiklibi) 125 mg, 100 mg ja 75 mg kalvopäällysteiset tabletit
Käyttöaiheet: Hormonireseptoripositiivinen ja HER2-negatiivinen paikallisesti edennyt tai metastasoitunut rintasyöpä. Ibrance yhdistetään aromataasinestäjään tai, jos potilas on saanut aiemmin hormonaalista hoitoa, fulvestranttiin. Pre- tai perimenopausaalisilla potilailla yhdistelmään tulee lisätä LHRH-agonisti. Annostus ja antotapa: Hoitavan lääkärin tulee olla perehtynyt syöpälääkkeiden käyttöön. On suositeltavaa, että neutrofiilien absoluuttinen määrä on ≥ 1,0 x 109/L ja verihiutalemäärä ≥ 50 x 109/L ennen hoidon aloitusta. Suositeltu aloitusannostus on 125 mg x 1/vrk 21 perättäisenä päivänä, minkä jälkeen on 7 päivän tauko (3/1 hoito-ohjelma). Annostusta voidaan muuttaa yksilöllisin perustein 100 mg:aan tai 75 mg:aan x 1/vrk 3/1 hoito-ohjelmalla. Jos potilaalla on vaikea maksan vajaatoiminta, suositusannos on 75 mg x 1/vrk 3/1 hoito-ohjelmalla. Hoitoa jatketaan niin kauan kuin potilas hyötyy hoidosta kliinisesti tai kunnes ilmenee toksisuutta, joka ei ole hyväksyttävää. Hoidon hallinta saattaa edellyttää annostelun tilapäistä keskeyttämistä tai seuraavan hoitosyklin aloituksen siirtämistä. Aromataasinestäjää tai fulvestranttia annostellaan ko. valmisteesta annettua suositusta noudattaen. Vasta-aiheet: Yliherkkyys palbosiklibille tai valmisteen apuaineille. Mäkikuismaa sisältävien valmisteiden käyttö. Varoitukset ja käyttöön liittyvät varotoimet: Henkeä uhkaava viskeraalinen metastasointi: Ei tutkittu potilailla, joilla on henkeä uhkaavia sisäelinmetastaaseja. Hematologinen toksisuus: Hematologista toksisuutta on raportoitu, yleisimmin neutropeniaa ja leukopeniaa. Vaikeusasteen 3 neutropeniaa on raportoitu 57 %:lla ja vaikeusasteen 4 neutropeniaa 11 %:lla potilaista. Kuumeista neutropeniaa on raportoitu n. 2 %:lla potilaista. Vaikeusasteen 3 leukopeniaa on raportoitu 29 %:lla ja vaikeusasteen 4 leukopeniaa 0,8 %:lla potilaista. Täydellinen verenkuva tulee määrittää ennen hoidon aloittamista, jokaisen hoitosyklin alussa ja kahden ensimmäisen hoitosyklin aikana myös päivänä 15. Tarvittaessa määrityksiä tulee toistaa tiheämmin. Infektiot: Saattaa altistaa infektioille. Vaikeusasteen 3 infektioita on raportoitu 5,6 %:lla ja vaikeusasteen 4 infektioita 0,9 %:lla potilaista. Potilasta tulee seurata infektion merkkien ja oireiden varalta. Potilasta on kehotettava ilmoittamaan heti, jos kuumetta ilmenee. Interstitiaalinen keuhkosairaus (ILD)/pneumoniitti: Jonkin vaikeusasteen ILD:ta/pneumoniittia on raportoitu 1,4 %:lla potilaista. Vaikea, henkeä uhkaava tai kuolemaan johtava ILD/pneumoniitti voi ilmetä. Potilasta tulee tarkkailla keuhko-oireiden varalta. Ibrance-hoito tulee keskeyttää, jos ILD:ta/pneumoniittia epäillään, ja se tulee lopettaa pysyvästi, jos vaikea ILD/pneumoniitti todetaan. Iho ja ihonalainen kudos: Ihon lupus erythematosusta voi esiintyä. Kliinisissä tutkimuksissa raportoitiin ihon lupus erythematosus 0,1 %:lla potilaista. Laskimotromboembolia: Potilasta tulee seurata syvän laskimotromboosin ja keuhkoembolian merkkien varalta. Maksan tai munuaisten vajaatoiminta: Annettava varoen potilaalle, jolla on keskivaikea tai vaikea maksan tai munuaisten vajaatoiminta. Toksisuuden merkkejä tulee seurata tarkoin. Yhteisvaikutukset: Vältettävä voimakkaiden CYP3A:n estäjien ja induktoreiden samanaikaista käyttöä. Ibrancen annos tulee pienentää 75 mg:aan yhteiskäytössä voimakkaan CYP3A:n estäjän kanssa. Annosta voidaan joutua pienentämään samanaikaisessa käytössä herkkien CYP3A:n substraattien kanssa, joilla on kapea terapeuttinen indeksi. Yhteiskäyttö sellaisten statiinien kanssa, jotka ovat CYP3A4:n ja/tai BCRP:n substraatteja, voi lisätä rabdomyolyysin riskiä. Muut, ks. valmisteyhteenveto. Hedelmällisyys, raskaus ja imetys: Hedelmällisessä iässä olevan potilaan ja hänen partnerinsa on käytettävä raskauden ehkäisyä. Ei suositella käytettävän raskauden aikana eikä hoidon aikana tule imettää. Vaikutus ajokykyyn ja koneiden käyttökykyyn: Voi aiheuttaa väsymystä, joten autoa ajettaessa tai koneita käytettäessä on noudatettava varovaisuutta. Haittavaikutukset: Hyvin yleiset: Infektiot, neutropenia, leukopenia, anemia, trombosytopenia, ruokahalun heikkeneminen, suutulehdus, pahoinvointi, ripuli, oksentelu, ihottuma, hiustenlähtö, ihon kuivuminen, väsymys, voimattomuus, kuume, kohonnut ALAT-arvo ja kohonnut ASAT-arvo. Yleiset: kuumeinen neutropenia, makuhäiriö, näön hämärtyminen, kyynelerityksen lisääntyminen, silmien kuivuminen, laskimotromboembolia, nenäverenvuoto, ILD/pneumoniitti, käsi-jalkaoireyhtymä, veren kohonnut kreatiinipitoisuus. Muut, ks. valmisteyhteenveto. Reseptilääke. Pakkaukset ja hinnat: 125 mg 21 tabl., 100 mg 21 tabl. ja 75 mg 21 tabl. Ajantasaiset hintatiedot www.kela.fi/laakkeet_laakehaku Korvattavuus: Rajoitettu erityiskorvaus 100 % (1501). Lisätietoja: Valmisteyhteenveto ja Pfizer Oy, Tietokuja 4, 00330 Helsinki, puh. 09 430 040. Teksti perustuu 17.10.2024 päivättyyn valmisteyhteenvetoon.